Actions de régénération et de protection du peptide GHK-Cu
À la lumière des nouvelles données génétiques
De Loren Pickart and Anna Margolina
httpss://www.ncbi.nlm.nih.gov/pmc/articles/PMC6073405/
Article français traduit de l’anglais, publication web en 2018
Abstrait
Le peptide humain GHK (glycyl-l-histidyl-l-lysine) a de multiples actions biologiques qui, selon nos connaissances actuelles, semblent être positives pour la santé. Il stimule la croissance des vaisseaux sanguins et des nerfs, augmente la synthèse du collagène, de l’élastine et des glycosaminoglycanes, ainsi que la fonction des fibroblastes dermiques. La capacité de GHK à améliorer la réparation des tissus a été démontrée pour la peau, le tissu conjonctif du poumon, le tissu osseux, le foie et la muqueuse de l’estomac. Il a également été démontré que GHK posséde de puissantes actions protectrices cellulaires, telles que de multiples activités anticancéreuses et anti-inflammatoires, une protection des poumons et la restauration des fibroblastes de la maladie pulmonaire obstructive chronique (MPOC), la suppression de molécules censées accélérer les maladies du vieillissement, comme le NF-κB, activités anti-anxiété, anti-douleur et anti-agression, réparation de l’ADN et activation du nettoyage cellulaire via le système protéasome. Des données génétiques récentes pourraient expliquer de telles actions protectrices et cicatrisantes d’une molécule, révélant de multiples voies biochimiques régulées par la GHK.
Mots-clés: GHK, GHK-Cu, profilage génétique, cicatrisation, BPCO, régénération de la peau, anti-oxydant, fibrinogène
NF-κB pour nuclear factor-kappa B est une protéine de la super-famille des facteurs de transcription impliquée dans la réponse immunitaire et la réponse au stress cellulaire. Cette dernière est associée aux facteurs anti-apoptotiques. Elle effectue donc un rétrocontrôle négatif de l’apoptose. C’est un sujet de recherche actuellement très étudié dans la mesure où plusieurs centaines de modulateurs de NF-κB sont connus et plus d’un millier de gènes cibles de ce facteur de transcription ont été identifiés.
1. Introduction
Le peptide humain de liaison au cuivre GHK-Cu (glycyl-1-histidyl-1-lysine) est un petit peptide naturel présent dans le plasma humain qui peut également être libéré par les tissus en cas de lésion. Depuis sa découverte en 1973, le GHK-Cu s’est imposé comme un puissant ingrédient protecteur et régénérant, couramment utilisé dans les produits pour la peau et les cheveux [1].
À ce jour, il est établi que GHK-Cu est capable de:
- Serrer la peau lâche et l’amincissement inverse de la peau âgée.
- Réparer les protéines protectrices de la peau.
- Améliore la fermeté, l’élasticité et la clarté de la peau.
- Réduit les ridules, la profondeur des rides et améliore la structure de la peau vieillie.
- Lisse la peau rugueuse
- Réduit les dommages photographiques, l’hyper pigmentation tachetée, les taches cutanées et les lésions
- Améliore l’apparence générale de la peau
- Stimule la cicatrisation
- Protège les cellules de la peau des rayons UV
- Réduit l’inflammation et les dommages des radicaux libres
- Augmente la croissance et l’épaisseur des cheveux
- Augmente la taille du follicule pileux
La plupart des auteurs attribueraient les effets de la GHK à sa capacité à se lier aux ions cuivre (II). En raison de sa petite taille et de sa capacité à lier le cuivre, le GHK pourrait jouer un rôle crucial dans le métabolisme du cuivre [2]. Cependant, depuis 2010, un nouveau mécanisme a commencé à émerger. Le Broad Institute of MIT et Harvard (Cambridge, Massachusetts, États-Unis) ont créé Connectivity Map, une bibliothèque de réponses transcriptionnelles accessible au public, destinée à des perturba-gènes connus, des substances modulant l’expression des gènes [3]. Cet outil a permis aux chercheurs d’étudier les effets de la GHK sur l’ensemble du génome et d’établir que cette dernière est capable de réguler à la hausse et à la baisse un nombre important de gènes humains. Aujourd’hui, il est devenu possible de relier les effets biologiques de la GHK-Cu et ses effets sur l’expression des gènes afin de développer une vision plus complète du mécanisme d’action de la GHK [4].
Le présent article passe en revue les actions de protection et de régénération du peptide GHK-Cu sur la peau humaine, ainsi que de nouvelles données génétiques, révélant les mécanismes possibles de ces actions.
2. GHK et expression génique
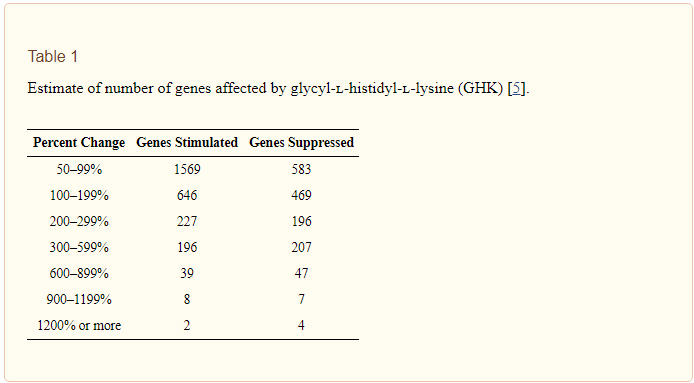
Le nombre de gènes humains stimulés ou supprimés par la GHK avec une modification supérieure ou égale à 50% est de 31,2%. La GHK augmente l’expression des gènes dans 59% des gènes et la supprime dans 41%. Pour nos études, nous avons utilisé les résultats d’expression génique à 50%. Cela donnait la meilleure corrélation avec nos données biologiques. Le tableau 1 présente une estimation du nombre de gènes affectés par la GHK à différents points limites.
2.1. GHK améliore la régénération de la peau
La capacité de la peau à supporter les dommages et à se réparer est plus élevée chez les enfants et les jeunes individus en raison du bon fonctionnement des mécanismes de réparation et de protection. Cependant, avec l’âge, la capacité de la peau à réparer les dommages diminue. La teneur en GHK est la plus élevée dans le plasma des individus jeunes et en bonne santé. À 20 ans, le taux plasmatique de GHK est d’environ 200 ng / mL (10−7 M) et à 60 ans, il diminue à 80 ng / mL. Dans l’expérience qui a conduit à la découverte de la GHK, le plasma de jeunes individus ajouté au tissu hépatique provenant d’individus âgés a amené les vieux tissus hépatiques à produire des protéines plus caractéristiques des individus plus jeunes [6].
Dans les années 1980, Maquart et al. Proposa que le GHK pourrait être un signal précoce pour la réparation de la peau. La séquence d’acides aminés GHK est présente dans la chaîne alpha 2 (I) du collagène de type I et, lorsque les dommages activent les enzymes protéolytiques, le GHK est libéré dans le site de la lésion [7]. Un certain nombre d’expériences ont démontré que la GHK stimule la synthèse du collagène, de certains glycosaminoglycanes et de la petite protéoglycane décorine [8,9]. Il module également l’activité des métalloprotéinases clés, qui sont des enzymes facilitant la dégradation des protéines de la matrice extracellulaire, ainsi que l’activité des anti-protéases. Ceci suggère un effet régulateur général sur la dégradation des protéines cutanées, aidant à prévenir à la fois l’accumulation de protéines endommagées et la protéolyse excessive [10,11]. Étant donné qu’une dégradation excessive de la matrice dermique et une élimination inadéquate des protéines endommagées peuvent nuire à la santé et à l’apparence de la peau, la capacité de GHK à réguler à la fois les métalloprotéinases et leurs inhibiteurs peut favoriser la régénération de la peau et améliorer son apparence.
La GHK a également démontré des effets bénéfiques sur les fibroblastes cutanés, considérés comme des cellules clés dans le processus de régénération de la peau. Les fibroblastes synthétisent non seulement les éléments structurels de la matrice dermique, mais produisent également une vaste gamme de facteurs de croissance essentiels à la réparation de la peau. Le GHK, en combinaison avec l’irradiation par LED (irradiation par diode électroluminescente, 625–635 nm), comparé à l’irradiation par LED uniquement augmentée: viabilité cellulaire 12,5 fois supérieure, production du facteur de croissance des fibroblastes basique (bFGF), 230% et synthèse du collagène 70% [12].
Il a été démontré que le GHK-Cu stimule les cellules basales de l’épiderme, augmentant de façon marquée les intégrines et l’expression de p63. La forme des cellules est devenue plus cuboïdale, ce qui indique une augmentation de leur souche [13].
2.2. Utilisation cosmétique de GHK-Cu
Un certain nombre d’études cliniques ont confirmé la capacité de GHK-Cu à améliorer l’apparence de la peau vieillissante. Une crème pour le visage à base de GHK-Cu appliquée pendant 12 semaines sur la peau du visage de 71 femmes présentant des signes légers à avancés de photo-vieillissement augmente la densité et l’épaisseur de la peau, réduise la laxité, améliore la transparence, atténue les ridules et la profondeur des rides [14].
Une crème pour les yeux GHK-Cu appliquée pendant 12 semaines sur le contour de l’œil de 41 femmes présentant une photo-dégradation (photodamage) légère à avancée a obtenu de meilleurs résultats que le placebo et la crème à la vitamine K. Il réduit les rides et les ridules, améliore l’apparence générale et augmente la densité et l’épaisseur de la peau [15].
L’application du GHK-Cu sur la peau de la cuisse pendant 12 semaines a amélioré la production de collagène chez 70% des femmes traitées, alors que 50% ont reçu la crème à la vitamine C et 40%, l’acide rétinoïque [16]. En plus d’améliorer la laxité de la peau, la clarté, la fermeté et l’apparence, de réduire les ridules, les rides grossières et la pigmentation tachetée, et d’augmenter la densité et l’épaisseur de la peau, la crème GHK-Cu appliquée deux fois par jour pendant 12 semaines a également fortement stimulé la prolifération des kératinocytes dermiques [17].
Dans leur étude pilote sur l’application topique de complexes de tripeptides de cuivre sur une peau âgée, Krüger et al. ont confirmé une augmentation de l’épaisseur de la peau dans le niveau de l’épiderme et du derme, une meilleure hydratation de la peau, un lissage important de la peau en stimulant la synthèse de collagène, une élasticité accrue de la peau, une amélioration significative du contraste de la peau et une production accrue de collagène I [18, 19].
La GHK-Cu à 0,01, 1 et 100 nM incubée avec des fibroblastes dermaux adultes chez l’homme a augmenté la production d’élastine et de collagène. La GHK a également augmenté l’expression des gènes de MMP1 et MMP2 à 0,01 nM. Toutes les concentrations ont augmenté TIMP1. Les effets de GHK-Cu ont également été étudiés dans le cadre d’un essai clinique randomisé à double aveugle. Des volontaires féminins ont appliqué du GHK-Cu encapsulé dans un porteur de nano-lipides deux fois par jour pendant 8 semaines, en utilisant soit le porteur seul, soit le peptide disponible dans le commerce, Matrixyl® 3000, comme contrôle. Par rapport au Matrixyl® 3000, le GHK-Cu a entraîné une réduction de 31,6% du volume des rides. Par rapport au sérum témoin, le GHK-Cu a réduit le volume des rides de 55,8% et la profondeur des rides de 32,8% [20].
2.3 Des études sur des animaux confirment l’activité de guérison de la GHK sur les plaies
Plusieurs études animales ont établi l’activité cicatrisante de la GHK. Il semble que la GHK stimule la cicatrisation des plaies par divers mécanismes. Dans les plaies expérimentales de lapin, la GHK seule ou en association avec une forte dose de laser hélium-néon a amélioré la contraction de la plaie et la formation de tissu granulaire, ainsi que l’augmentation de l’activité des enzymes antioxydantes et la stimulation de la croissance des vaisseaux sanguins [21,22]. Le pansement au collagène avec GHK incorporé (PIC-Peptide Incorporated Collagen) accélère la cicatrisation des plaies chez des rats sains et diabétiques. Le groupe traité présentait des taux plus élevés de glutathion (GSH) et d’acide ascorbique, une meilleure épithélialisation, ainsi qu’une synthèse accrue de collagène et une activation des fibroblastes et des mastocytes dans les plaies. Chez les rats en bonne santé, le traitement des plaies avec du PIC a multiplié par neuf le collagène [23,24]. Le GHK-Cu a amélioré la cicatrisation des plaies ouvertes ischémiques chez le rat. Les plaies présentaient une cicatrisation plus rapide, une concentration réduite en métalloprotéinases 2 et 9 ainsi que du TNF-β (une cytokine inflammatoire majeure) par rapport au véhicule seul ou avec des plaies non traitées [25].
Un problème avec GHK-Cu est qu’il est très sensible à la dégradation par les enzymes carboxypeptidases. Les plaies telles que les ulcères cutanés ou les escarres diabétiques développent généralement un «sérum de plaie», qui serait généré par les bactéries en suspension dans l’air qui se déposent sur la plaie. Le «sérum» décompose rapidement la GHK et probablement d’autres facteurs de croissance tels que le TGF (facteur de croissance transformant) et le PDGF (facteur de croissance dérivé des plaquettes).
2.4 Stimulation de la croissance des vaisseaux sanguins et des nerfs
La croissance des nerfs et des vaisseaux sanguins est un facteur important dans la guérison et la régénération de la peau.
Sage et al. ont observé que la GHK et les peptides apparentés sont produits au cours de la dégradation de la protéine après une lésion provoquée par une protéine SPARC. SPARC (protéine sécrétée acide et riche en cystéine) est une glycoprotéine, principalement exprimée dans les tissus embryonnaires et dans les tissus en cours de réparation et de remodelage. Aux stades initiaux de la réparation tissulaire, la GHK et d’autres peptides contenant la séquence GHK (tels que KGHK), qui sont libérés par SPARC au cours de la protéolyse, stimulent la croissance de nouveaux vaisseaux. Plus tard dans le processus de guérison, les peptides apparentés à la GHK et à la GHK inhibent la croissance des vaisseaux sanguins [26].
Promotion de l’excroissance nerveuse
Lorsque la cicatrisation cutanée est insuffisante, la zone cicatrisée est souvent dépourvue de capacités sensorielles. Dans les cultures cellulaires, les laboratoires de Monique Sensenbrenner (France) et de Gertrude Lindler (Allemagne) ont découvert que la GHK stimule la croissance nerveuse, un attribut essentiel de la réparation cutanée. La GHK aide à restaurer l’innervation de la peau en augmentant la production de facteurs neurotrophiques [27,28].
Ahmed et ses collègues du laboratoire de neurochimie de Chennai, en Inde, ont écrit que lorsque des nerfs sectionnés chez un rat sont placés dans un tube de collagène imprégné de GHK, la croissance nerveuse est accrue. GHK-Cu augmente la production de facteur de croissance nerveuse et les neurotrophines NT-3 et NT-4, accélère la régénération des fibres nerveuses à partir de souches nerveuses placées dans un tube de collagène et augmente le nombre d’axones et la prolifération de cellules de Schwann par rapport au groupe témoin [29]
Lorsque nous avons recherché les effets de l’activation des gènes de GHK sur l’ontologie des neurones du gène Ontology, nous avons trouvé 408 gènes de plus et 230 gènes de moins. Le GHK a donc un effet significatif sur les neurones, mais nous ne savons pas exactement ce que cela signifie. Avec le temps, nous pourrons analyser l’énorme quantité de données. Le tableau 2 présente les 10 principaux gènes régulés positivement par la GHK et les 10 principaux régulés négativement [30].
2.5 Actions anti-oxydantes et anti-inflammatoires
Comme le montrent les expériences sur les animaux, le traitement des plaies avec de la GHK entraîne une augmentation des taux d’enzymes antioxydantes. GHK possède également de fortes actions antioxydantes et anti-inflammatoires. La GHK inactive les sous-produits de radicaux libres nocifs de la peroxydation lipidique, tels que le 4-hydroxynone, l’acroléine, le malondialdéhyde et le glyoxal, protégeant les kératinocytes cutanés en culture des rayons ultraviolets (UV) [31]. Il a été démontré que la GHK bloquait complètement l’oxydation des lipoprotéines de basse densité (LDL) dépendante de Cu (2 +). Un autre anti-oxydant bien connu, qui est également largement utilisé dans les soins de la peau, la superoxyde dismutase (SOD1), ne fournissait que 20% de la protection [32]. GHK empêche également les effets nocifs de la peroxydation lipidique en liant ses sous-produits tels que l’acroléine et le 4-hydroxynonénal [33,34].
GHK: Cu (2+) a réduit de 87% la libération de fer par la ferritine. La ferritine dans le plasma sanguin peut stocker jusqu’à 4500 atomes de fer par molécule de protéine, un catalyseur bien connu de la peroxydation des lipides – une réaction en chaîne qui produit une flopée de radicaux libres, entraînant des dommages à l’ADN, aux protéines et aux membranes cellulaires. Les perturbations du métabolisme du fer contribuent à de nombreuses affections pathologiques, notamment des lésions cérébrales et la mort neuronale dans diverses affections neurologiques. Lorsque le fer est libéré par la ferritine, il peut former un complexe Fe (2+) / Fe (3+) et déclencher la réaction en chaîne de l’oxydation lipidique [35].
2.6 MPOC pulmonaire et lésion pulmonaire aiguë
MPOC : maladie pulmonaire obstructive chronique, principalement bronchite chronique et l’emphysème.
Une régénération tissulaire réussie nécessite la collaboration de plusieurs cellules, qui sont orchestrées par diverses cytokines et facteurs de croissance. Cela signifie que pour que la régénération soit réussie, ces molécules doivent être produites et libérées dans les quantités et au lieu appropriés. Ceci est important car aucune molécule de signal ne fonctionne seule, mais s’engage dans une diaphonie, ce qui conduit à l’activation de certaines voies cellulaires. Parmi les voies impliquées dans la régénération de la peau figurent les voies cellulaires régulées par le TGF-β et les intégrines [36].
La GHK semble soutenir le remodelage et la restructuration du tissu conjonctif, modulant l’expression de nombreux gènes, y compris la régulation à la hausse des gènes de la voie du TGF-β. C’est ce qui ressort d’une étude démontrant la capacité de la GHK à inverser l’expression de gènes clés, incluse dans une signature génétique de la MPOC, la maladie pulmonaire obstructive chronique. L’expression de 127 gènes a été modifiée chez les patients atteints de MPOC. Des symptômes d’emphysème plus graves ont été corrélés au degré de changement dans l’expression des gènes. Les gènes dont l’expression était associée à l’inflammation étaient régulés positivement, et les gènes impliqués dans le remodelage et la réparation des tissus étaient fortement régulés. À l’aide de Connectivity Map, un outil logiciel de profilage des gènes développé par le Broad Institute, les chercheurs ont analysé les profils d’expression génique de molécules biologiques et proposé GHK comme composé capable d’inverser les modifications de l’expression des gènes associées à la destruction emphysémateuse, telles que la baisse d’activité de gènes impliqués dans la voie du TGF-β. La GHK a été en mesure de modifier le schéma d’expression des gènes en l’inverse: l’activation de la voie du TGF-β.
La GHK a ensuite été testée in vitro pour confirmer ses effets positifs sur le tissu conjonctif. Les fibroblastes pulmonaires de patients atteints de BPCO (La bronchopneumopathie chronique obstructive), qui avaient une capacité altérée de contracter et de restructurer le collagène, ont été traités avec de la GHK ou du TGF-β. Les deux molécules ont restauré la fonction des fibroblastes. Ils présentaient également une expression élevée d’intégrine bêta 1 [37,38].
L’utilisation de GHK-Cu chez des souris protège leur tissu pulmonaire des lésions pulmonaires aiguës induites et supprime l’infiltration de cellules inflammatoires dans les poumons. La GHK-Cu a également augmenté l’activité de la superoxyde dismutase (SOD) tout en diminuant la production de TNF-1 et d’IL-6 par le biais de l’activation bloquante des protéines p65 et p38 MAPK de NFKB. Les protéines kinases activées par les mitogènes sont des enzymes kinases qui jouent un rôle crucial dans la signalisation cellulaire. Les voies P38 MAPK permettent aux cellules de répondre à un large éventail d’agents de stress externes et affectent la différenciation de la peau, l’apoptose, la mobilité et l’expression des gènes. On a constaté que l’activation de NFKB p65 était corrélée à de nombreuses maladies liées au vieillissement et au développement d’un cancer [39].
2.7 Blocage des effets de la cortisone
Les stéroïdes topiques, tels que la cortisone, sont souvent prescrits pour le traitement des troubles cutanés inflammatoires, peuvent inhiber la réparation des plaies, ainsi que produire un amincissement de la peau et d’autres défauts [40].
Le GHK-Cu, administré par voie systémique à la souris, au rat et au porc, a des effets protecteurs sur l’inhibition de la cicatrisation de la plaie induite par la cortisone [41].
2.8 Suppression du fibrinogène
La GHK a été isolée sous forme de molécule plasmatique supprimant le fibrinogène. Le fibrinogène est surtout connu pour sa capacité à former des caillots sanguins. Cependant, il influence également fortement la circulation du sang dans la micro-circulation, où le sang agit comme un fluide thixotrope, un peu comme un dentifrice, s’écoulant lorsque la pression artérielle est augmentée, puis redevient un gel semi-solide. Le fibrinogène élevé augmente considérablement la viscosité du sang dans la micro-circulation en augmentant la « formation » d’empilement de globules rouges ou de rouleaux. Des études menées en Allemagne et en Écosse ont montré que les taux de fibrinogène constituaient le principal facteur de risque de maladies cardiovasculaires (MCV). L’étude prospective Cardiovascular Münster (PROCAM) a suivi 5389 hommes pendant 10 ans. Il a été constaté que l’incidence d’événements coronaires dans le tiers supérieur des taux plasmatiques de fibrinogène était 2,4 fois plus élevée que dans le tiers inférieur. Les individus se situant dans le tiers supérieur des niveaux de cholestérol des lipoprotéines de basse densité (LDL) et présentant également des concentrations plasmatiques élevées de fibrinogène présentaient un risque coronaire 6,1 fois plus élevé. De façon inattendue, les coronaires étaient peu fréquents chez les sujets présentant un taux de fibrinogène plasmatique faible, même lorsque le cholestérol LDL sérique était élevé [42].
La Scottish Heart Health Study a suivi 10 359 hommes et femmes pendant 2 ans et le fibrinogène était le facteur de risque le plus puissant du risque de MCV ou de décès et plus prédictif que le cholestérol lipoprotéique. L’augmentation du risque relatif entre les taux de fibrinogène les plus élevés et les plus faibles était de 301% pour les hommes et de 342% pour les femmes (décès par MCV), de 259% pour les hommes et de 220% pour les femmes (toutes causes confondues) [43].
Comme mentionné ci-dessus (Park et al.), Le GHK inhibe la production d’interleukine-6, un des principaux régulateurs positifs de la production de fibrinogène, à la fois dans les cultures cellulaires et chez la souris. Comme nos données de profilage de gènes l’indiquent, la GHK régule de manière négative (-475%) le gène de la chaîne bêta du fibrinogène. Étant donné que des quantités égales des trois chaînes polypeptidiques sont nécessaires pour produire le fibrinogène, lorsque la synthèse de l’une des chaînes du fibrinogène est inhibée, il aura un effet inhibiteur général sur la synthèse du fibrinogène [44].
2.9 Actions de remodelage cutané et anti-cancer
Une des principales préoccupations de toute substance, qui active la croissance cellulaire et le remodelage des tissus, est de savoir si elle peut également déclencher le cancer. Par conséquent, il est très important de noter que le GHK, qui répare la peau, possède également de puissantes propriétés anticancéreuses.
En 2010, Hong et al. a utilisé la carte de connectivité du Broad Institute pour trouver des molécules pouvant inhiber le cancer du colon métastatique. La carte de connectivité contient les profils d’expression évalués dans cinq lignées de cellules cancéreuses, en réponse à 1 309 petites molécules bioactives. Une recherche dans la base de données n’a produit que deux substances capables de réguler négativement l’expression de gènes «métastatiques»: deux substances de remodelage de la peau, la GHK, et l’alcaloïde de plante, la sécurinine. Le GHK a produit le résultat à une faible concentration non toxique de 1 micromolaire et la sécurinine à 18 micromolaires. Le GHK inhibe la production d’ARN dans 70% des 54 gènes humains surexprimés chez les patients cancéreux, notamment les «molécules nodales» YWHAB, MAP3K5, LMNA, APP, GNAQ, F3, NFATC2 et TGM2. Ces molécules jouent un rôle clé dans la régulation de voies moléculaires importantes [45]. Cela montre que la GHK est impliquée dans la régulation génique de diverses voies biochimiques et qu’elle semble réinitialiser l’activité du gène sur la santé, ce qui conduit à une amélioration de la réparation tissulaire [46].
Les rayons UV et d’autres facteurs dommageables peuvent endommager l’ADN des cellules de la peau, ce qui peut entraîner le cancer de la peau. L’apoptose ou mort cellulaire programmée est l’un des principaux mécanismes de protection. Les cellules cutanées normales et saines ont des systèmes de points de contrôle pour s’autodétruire si elles ne synthétisent pas correctement l’ADN. Lorsque l’apoptose est inhibée, le risque de cancer de la peau augmente considérablement. L’apoptose est également le mécanisme par lequel de nombreux traitements anticancéreux, y compris les traitements du mélanome, agissent. Certains ingrédients cosmétiques courants, tels que l’extrait de baies de sureau, peuvent améliorer l’efficacité du traitement du cancer en renforçant l’apoptose dans les cellules malignes [47].
Matalka et al. ont démontré que la GHK, entre 1 et 10 nM, inhibait la croissance des cellules de neuroblastome humain SH-SY5Y et des cellules de lymphome histiocytaire U937 humain. Il a également réactivé le système d’apoptose, mesuré par les caspases 3 et 7. En revanche, la GHK a stimulé la croissance de fibroblastes humains en santé NIH-3T3 [48].
En 1983, en utilisant une méthode développée par le groupe de Linus Pauling [5], nous avons testé le mélange de GHK-cuivre 2+ et d’acide ascorbique (vitamine C) sur la croissance du sarcome 180 chez la souris. Cela a donné une très forte suppression du cancer. Ces résultats sont restés non publiés jusqu’en 2014, date à laquelle nous avons pu compléter ces résultats avec des données génétiques. Nous avons utilisé la carte de connectivité du Broad Institute pour étudier l’effet de la GHK sur les gènes pertinents pour la croissance du cancer. La GHK a régulé à la hausse l’expression de 10 gènes associés à la caspase et à la caspase. Il a également affecté 84 gènes associés à la réparation de l’ADN et à d’autres processus liés aux effets anticancéreux. L’activité anticancéreuse de la GHK pourrait être liée à ses effets connus sur le remodelage tissulaire [49].
2.10 Ubiquitin Proteasome System
Le système de protéasome à ubiquitine (UPS) est un système qui traite et élimine les protéines endommagées. Lorsque ce système ne fonctionne pas correctement, les protéines endommagées peuvent commencer à s’accumuler. Le vieillissement est associé à une activité réduite du système protéasome à ubiquitine. Jusqu’à présent, il n’existait aucun traitement efficace pour augmenter l’activité de l’onduleur. Des travaux récents ont démontré que l’activation du protéasome par des moyens génétiques ou par l’utilisation de composés ralentit le vieillissement [50].
Nous avons effectué une recherche en utilisant des titres de gènes contenant «ubiquitine» ou «protéasome». GHK stimule fortement l’expression génique du système UPS, augmentant l’activité de 41 gènes et supprimant 1 gène. Voir tableau 3
Selon les données du Broad Institute, les gènes de l’UPS ont changé d’au moins 50%. La GHK augmentait l’expression génique dans 41 gènes UPS tout en supprimant 1 gène UPS. Cela devrait avoir un effet positif sur ce système.
2.11 Anti-Douleur, Anti-Anxiété, Anti-Agression
GHK possède de puissantes actions anti-douleur, anti-anxiété (anxiolytique) et anti-agression.
Les effets anti-douleur ont été mesurés en déterminant le temps nécessaire aux souris pour se lécher les pattes après avoir été placées sur une plaque chauffée légèrement. Ici, le GHK réduit la douleur à une dose de 0,5 milligramme / kilogramme. La GHK a une structure physique similaire à celle de la cimétidine, souvent utilisée pour réduire la douleur chez l’homme [51,52].
Les actions anti-anxiété, anti-douleur et anti-agression ont été trouvées chez le rat. Quand les rats ont peur, ils essaient de se cacher. Mais dans les 12 minutes suivant l’injection intra-péritonéale de GHK à raison de 0,5 microgramme / kilogramme chez des rats dans une cage d’essai construite comme un labyrinthe, le temps passé par les rats à explorer davantage de zones ouvertes et éclairées du labyrinthe augmentait et le temps passé immobile (réaction de gel) a diminué, ce qui indique une réduction de la peur et de l’anxiété [53]. La même chose s’est produite dans un test «en champ libre», où les rats ont passé moins de temps à se cacher et plus de temps à explorer la région [54].
De même, les actions anti-agression ont été trouvées chez le rat. Pour l’expérience, deux rats sont placés dans une petite cage puis soumis à de petits chocs électriques, ce qui provoque la colère des rats et conduit à des attaques physiques sur l’autre rat. Les attaques ont été réduites de 5 fois lorsque les rats ont été placés dans un environnement stimulant l’agression 12 min après l’injection de 0,5 microgramme de GHK par kilogramme de poids corporel. Si l’on augmente le poids humain, cela suggère qu’un effet similaire pourrait être induit chez l’homme avec 35 microgrammes de GHK, ce qui représente un dosage très faible et sans danger [55].
Des études sur le passage de GHK à travers la peau par le laboratoire de Howard Maibach suggèrent qu’il serait possible de faire passer facilement une quantité suffisante de GHK-Cu à travers la peau pour réduire l’anxiété et éventuellement la douleur [56].
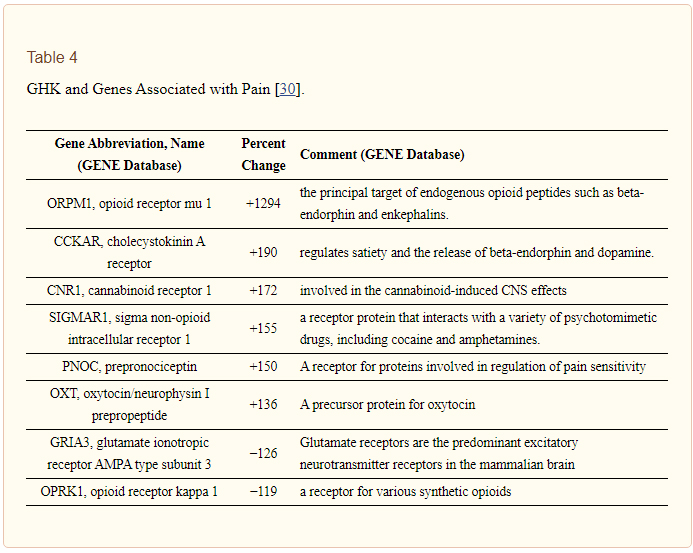
Une recherche manuelle des gènes affectés par la GHK a révélé que sept gènes anti-douleur augmentaient et deux gènes diminuaient. Les résultats sont présentés dans le tableau 4.
Le stress psychologique est une réponse adaptative qui peut être délétère dans certaines conditions. Le stress et l’anxiété retardent la récupération de la barrière épidermique, altèrent la fonction immunitaire de la peau, augmentent l’inflammation et le stress oxydatif. Il provoque l’activation de l’axe hypothalamus-hypophyso-surrénalien (HPA) et du système nerveux sympathique. La peau est affectée par les molécules libérées lors du stress, telles que les neuropeptides, les hormones et les cytokines [57]. Cela fait des effets analgésiques et anxiolytiques de la GHK une partie importante de ses effets cutanés. Des études montrent que la réduction de l’anxiété et du stress psychologique peut avoir un effet positif sur les affections cutanées chroniques telles que le psoriasis et la dermatite atopique [58]. Le stress chronique peut également nuire à la cicatrisation des plaies, nuisant ainsi au rétablissement après la chirurgie plastique et d’autres procédures esthétiques invasives [59,60]. Nous pensons que la molécule GHK a évolué en tant que première réponse à une blessure et, en tant que tel, il n’est pas surprenant qu’elle possède des effets analgésiques et anxiolytiques. Réduire le niveau d’hormones et de cytokines liées au stress pourrait aider les animaux à réduire l’inflammation et à augmenter les chances de survie.
2.12 GHK Formulation et Livraison
Le GHK-Cu peut pénétrer dans la couche cornée, ce qui assure son activité dans les formulations cosmétiques [61,62]. Cependant, pour augmenter la pénétration de GHK, il est conseillé d’utiliser des liposomes, y compris des liposomes de taille réduite [63].
GHK est sûr et très bon marché. Il peut être facilement incorporé dans des formulations protectrices de la peau, telles que des crèmes solaires, des crèmes et des sérums de jour, ainsi que des formulations antirides. En raison de sa capacité à améliorer la cicatrisation des plaies, il est recommandé après une chirurgie plastique, des peelings chimiques, la dermabrasion, un traitement au laser, etc. Il sera très utile dans un contexte clinique et dans des établissements pour personnes âgées assistées en tant que pansement, en particulier pour les plaies diabétiques et ischémiques.
Ses performances en matière de sécurité et sa capacité à inverser l’expression des gènes pour la santé justifient son utilisation en tant que complément alimentaire destiné à soutenir la santé et la vitalité de la peau, des cheveux et du corps tout entier.
3 Conclusions
La GHK est une petite molécule, qui possède une gamme étonnamment large de qualités bénéfiques pour la santé, alors que de nouvelles études révèlent encore une portée encore plus large des effets biologiques de la GHK.
Dans le passé, les actions de GHK liées à la cicatrisation, au remodelage des tissus, à la stimulation de l’angiogenèse, à la croissance cellulaire, aux propriétés anti-inflammatoire et anti-oxydante étaient attribuées à sa relation unique avec le cuivre. Le cuivre est un métal de transition essentiel pour tous les organismes eucaryotes, des microbes aux humains. Puisqu’il peut être converti de Cu (II) oxydé à une forme réduite de Cu (I), il fonctionne comme un co-facteur essentiel dans une multitude de réactions biochimiques impliquant un transfert d’électrons. Une douzaine d’enzymes (cuproenzymes) utilisent des modifications des états d’oxydation du cuivre pour catalyser des réactions biochimiques importantes, notamment la respiration cellulaire (cytochrome c oxydase), des défenses antioxydantes (céruloplasmine, superoxyde dismutase (SOD), détoxification (métallothionéines), coagulation sanguine (facteurs de coagulation sanguine V et VIII) et la formation du tissu conjonctif (lysylperoxydase) Le cuivre est nécessaire au métabolisme du fer, à l’oxygénation, à la neurotransmission, au développement embryonnaire et à de nombreux autres processus biologiques essentiels [64].
Bien que l’hypothèse du cuivre concernant le mode d’action de GHK soit toujours valable, nous pensons qu’elle n’explique pas les effets modulateurs des gènes de GHK-Cu. Par conséquent, à la lumière des nouvelles données sur les gènes, un nouveau modèle d’action GHK-Cu est nécessaire, ce qui nécessitera la collaboration de chercheurs de différents domaines.
Comme le révèlent de nouvelles études sur le profilage des gènes, la GHK avec et sans cuivre affecte un grand nombre de gènes liés à la réponse d’un organisme au stress et aux blessures (remodelage des tissus, anti-oxydant, anti-inflammatoire, anti-douleur, anti-anxiété, croissance des vaisseaux sanguins , excroissance nerveuse, action anticancéreuse). La séquence GHK est incluse dans la molécule de collagène, et la protéine SPARC et la GHK sont libérées naturellement après une lésion due à la dégradation de la protéine.
On sait maintenant que certains changements dans l’expression génique liés à l’âge ne sont pas permanents et peuvent être inversés. Des études montrent qu’un exercice physique régulier chez les personnes âgées, aussi peu que 30 minutes par jour trois fois par semaine, peut réinitialiser l’ADN humain mitochondrial en lui donnant une expression génique plus proche de celle d’une personne plus jeune. D’autres procédures telles que les régimes alimentaires sains, la consommation de vin et les suppléments de flavonoïdes peuvent modifier l’activité de certains gènes, et divers types de méthodes de médiation et de lutte contre le stress sont recommandés pour améliorer l’expression des gènes [65,66].
Cependant, la plupart des composés biologiques testés pour leurs effets sur l’expression des gènes à l’aide d’outils informatiques ne disposent souvent pas de données biologiques justificatives. La GHK a fait l’objet de nombreuses études pendant plus de quarante ans et ses effets biologiques et sur la sécurité ont été confirmés par des études sur des cellules, des tissus et des animaux. À notre avis, l’étude sur la MPOC (Campbell et al.) est la plus représentative à cet égard, car non seulement les signatures génétiques ont été dérivées de zones où la pathologie a été confirmée histologiquement, mais les effets de la GHK sur le tissu pulmonaire affecté ont également été testés in vitro et leurs effets ont été évalués. la corrélation avec les effets géniques était bien établie [37].
Le GHK est un composé sûr, peu coûteux et largement étudié qui a une multitude d’effets positifs et favorables à la santé dans de nombreux tissus et systèmes. Depuis des décennies, il est largement utilisé dans les produits cosmétiques et anti-âge pour l’homme, sans aucun effet indésirable. Il peut facilement être incorporé dans des crèmes, des liposomes, des timbres cutanés ou être administré via des microaiguilles. À l’heure actuelle, il n’est pas formulé en compléments alimentaires. À notre avis, développer et tester des produits à base de GHK à usage interne pour améliorer la santé des personnes âgées et constituer un traitement complémentaire du traitement du cancer est une des pistes possibles pour les recherches futures. Sur la base de données biologiques et génétiques, la GHK pourrait également devenir un traitement supplémentaire anti-anxiété et anti-douleur et pourrait constituer un élément essentiel d’une future approche complexe du traitement de la MPOC.
References
1. Pickart L. The human tri-peptide GHK and tissue remodeling. J. Biomater. Sci. Polym. Ed. 2008;19:969–988. doi: 10.1163/156856208784909435. [PubMed] [CrossRef] [Google Scholar]
2. Pickart L., Freedman J.H., Loker W.J., Peisach J., Perkins C.M., Stenkamp R.E., Weinstein B. Growth-modulating plasma tripeptide may function by facilitating copper uptake into cells. Nature. 1980;288:715–717. doi: 10.1038/288715a0. [PubMed] [CrossRef] [Google Scholar]
3. Lamb J. The Connectivity Map: A new tool for biomedical research. Nat. Rev. Cancer. 2007;7:54–60. doi: 10.1038/nrc2044. [PubMed] [CrossRef] [Google Scholar]
4. Pickart L., Vasquez-Soltero J.M., Margolina A. GHK and DNA: Resetting the human genome to health. BioMed Res. Int. 2014;2014:151479. doi: 10.1155/2014/151479. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
5. Kimoto E., Tanaka H., Gyotoku J., Morishige F., Pauling L. Enhancement of antitumor activity of ascorbate against Ehrlich ascites tumor cells by the copper: Glycylglycylhistidine complex. Cancer Res. 1983;43:824–828. [PubMed] [Google Scholar]
6. Pickart L. Ph.D. Thesis. University of California; San Francisco, CA, USA: 1973. A tripeptide in Human Serum That Promotes the Growth of Hepatoma Cells and the Survival of Normal Hepatocytes. [Google Scholar]
7. Maquart F.X., Pickart L., Laurent M., Gillery P., Monboisse J.C., Borel J.P. Stimulation of collagen synthesis in fibroblast cultures by the tripeptide-copper complex glycyl-l-histidyl-l-lysine-Cu2+ FEBS Lett. 1988;238:343–346. doi: 10.1016/0014-5793(88)80509-X. [PubMed] [CrossRef] [Google Scholar]
8. Siméon A., Wegrowski Y., Bontemps Y., Maquart F.X. Expression of glycosaminoglycans and small proteoglycans in wounds: Modulation by the tripeptide-copper complex glycyl-l-histidyl-l-lysine-Cu(2+) J. Investig. Dermatol. 2000;115:962–968. doi: 10.1046/j.1523-1747.2000.00166.x. [PubMed] [CrossRef] [Google Scholar]
9. Wegrowski Y., Maquart F.X., Borel J.P. Stimulation of sulfated glycosaminoglycan synthesis by the tripeptide-copper complex glycyl-l-histidyl-l-lysine-Cu2+ Life Sci. 1992;51:1049–1056. doi: 10.1016/0024-3205(92)90504-I. [PubMed] [CrossRef] [Google Scholar]
10. Siméon A., Monier F., Emonard H., Gillery P., Birembaut P., Hornebeck W., Maquart F.X. Expression and activation of matrix metalloproteinases in wounds: Modulation by the tripeptide-copper complex glycyl-l-histidyl-l-lysine-Cu2+ J. Investig. Dermatol. 1999;112:957–964. doi: 10.1046/j.1523-1747.1999.00606.x. [PubMed] [CrossRef] [Google Scholar]
11. Siméon A., Emonard H., Hornebeck W., Maquart F.X. The tripeptide-copper complex glycyl-l-histidyl-l-lysine-Cu2+ stimulates matrix metalloproteinase-2 expression by fibroblast cultures. Life Sci. 2000;22:57–65. doi: 10.1016/S0024-3205(00)00803-1. [PubMed] [CrossRef] [Google Scholar]
12. Huang P.J., Huang Y.C., Su M.F., Yang T.Y., Huang J.R., Jiang C.P. In vitro observations on the influence of copper peptide aids for the LED photoirradiation of fibroblast collagen synthesis. Photomed. Laser Surg. 2007;25:183–190. doi: 10.1089/pho.2007.2062. [PubMed] [CrossRef] [Google Scholar]
13. Kang Y.A., Choi H.R., Na J.I., Huh C.H., Kim M.J., Youn S.W., Kim K.H., Park K.C. Copper-GHK increases integrin expression and p63 positivity by keratinocytes. Arch. Dermatol. Res. 2009;301:301–306. doi: 10.1007/s00403-009-0942-x. [PubMed] [CrossRef] [Google Scholar]
14. Leyden J., Stephens T., Finkey M., Appa Y., Barkovic S. Skin Care Benefits of Copper Peptide Containing Facial Cream; Proceedings of the American Academy of Dermatology 60th Annual Meeting; New Orleans, LA, USA. 22–27 February 2002; p. 68. [Google Scholar]
15. Leyden J., Stephens T., Finkey M., Barkovic S. Skin Care Benefits of Copper Peptide Containing Eye Creams; Proceedings of the American Academy of Dermatology 60th Annual Meeting; New Orleans, LA, USA. 22–27 February 2002; p. 69. [Google Scholar]
16. Abdulghani A., Sherr A., Shirin S., Solodkina G., Tapia E., Wolf B., Gottlieb A.B. Effects of topical creams containing vitamin C, a copper-binding peptide cream and melatonin compared with tretinoin on the ultrastructure of normal skin—A pilot clinical, histologic, and ultrastructural study. Dis. Manag. Clin. Outcomes. 1998;1:136–141. doi: 10.1016/S1088-3371(98)00011-4. [CrossRef] [Google Scholar]
17. Finkley M., Appa Y., Bhandarkar S. Copper Peptide and Skin. In: Elsner P., Maibach H., editors. Cosmeceuticals and Active Cosmetics: Drugs vs. Cosmetics. Marcel Dekker; New York, NY, USA: 2005. pp. 549–563. [Google Scholar]
18. Krüger N., et al. Topische Applikation eines Kupfertripeptidkomplexes: Pilotstudie bei gealterter Haut. J. Dtsch. Dermatol. Ges. 2003;1 [Google Scholar]
19. Krüger N., Fiegert L., Becker D., Reuther T., Kerscher M. Zur Behandlung der Hautalterung: Spurenelemente in Form eines Kupfertripeptidkomplexes. Kos. Med. 2003;24:31–33. [Google Scholar]
20. Badenhorst T., Svirskis D., Merrilees M., Bolke L., Wu Z. Effects of GHK-Cu on MMP and TIMP Expression, Collagen and Elastin Production, and Facial Wrinkle Parameters. J. Aging Sci. 2016;4:166. doi: 10.4172/2329-8847.1000166. [CrossRef] [Google Scholar]
21. Cangul I.T., Gul N.Y., Topal A., Yilmaz R. Evaluation of the effects of topical tripeptide-copper complex and zinc oxide on open-wound healing in rabbits. Vet. Dermatol. 2006;17:417–423. doi: 10.1111/j.1365-3164.2006.00551.x. [PubMed] [CrossRef] [Google Scholar]
22. Gul N.Y., Topal A., Cangul I.T., Yanik K. The effects of topical tripeptide copper complex and helium-neon laser on wound healing in rabbits. Vet. Dermatol. 2008;19:7–14. doi: 10.1111/j.1365-3164.2007.00647.x. [PubMed] [CrossRef] [Google Scholar]
23. Arul V., Gopinath D., Gomathi K., Jayakumar R. Biotinylated GHK peptide incorporated collagenous matrix: A novel biomaterial for dermal wound healing in rats. J. Biomed. Mater. Res. B Appl. Biomater. 2005;73:383–391. doi: 10.1002/jbm.b.30246. [PubMed] [CrossRef] [Google Scholar]
24. Arul V., Kartha R., Jayakumar R. A therapeutic approach for diabetic wound healing using biotinylated GHK incorporated collagen matrices. Life Sci. 2007;80:275–284. doi: 10.1016/j.lfs.2006.09.018. [PubMed] [CrossRef] [Google Scholar]
25. Canapp S.O., Jr., Farese J.P., Schultz G.S., Gowda S., Ishak A.M., Swaim S.F., Vangilder J., Lee-Ambrose L., Martin F.G. The effect of topical tripeptide-copper complex on healing of ischemic open wounds. Vet. Surg. 2003;32:515–523. doi: 10.1111/j.1532-950X.2003.00515.x. [PubMed] [CrossRef] [Google Scholar]
26. Lane T.F., Iruela-Arispe M.L., Johnson R.S., Sage E.H. SPARC is a source of copper-binding peptides that stimulate angiogenesis. J. Cell Biol. 1994;125:929–943. doi: 10.1083/jcb.125.4.929. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Sensenbrenner M., Jaros G.G., Moonen G., Meyer B.J. Effect of conditioned media on nerve cell differentiation. Cell. Mol. Life Sci. 1980;36:660–662. doi: 10.1007/BF01970123. [PubMed] [CrossRef] [Google Scholar]
28. Lindner G., Grosse G., Halle W., Henklein P. The effect of a synthetic tripeptide nervous tissue cultured in vitro. Z. Mikrosk. Anat. Forsch. 1979;93:820–828. [PubMed] [Google Scholar]
29. Ahmed M.R., Basha S.H., Gopinath D., Muthusamy J., Jayakumar R.J. Initial upregulation of growth factors and inflammatory mediators during nerve regeneration in the presence of cell adhesive peptide-incorporated collagen tubes. J. Peripher. Nerv. Syst. 2005;10:17–30. doi: 10.1111/j.1085-9489.2005.10105.x. [PubMed] [CrossRef] [Google Scholar]
30. Pickart L., Vasquez-Soltero J., Margolina A. The Effect of the Human Peptide GHK on Gene Expression Relevant to Nervous System Function and Cognitive Decline. Brain Sci. 2017;7:20. doi: 10.3390/brainsci7020020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Cebrian J., Messeguer A., Facino R., Garcia Anton J. New anti-RNS and -RCS products for cosmetic treatment. Int. J. Cosmet. Sci. 2005;27:271–278. doi: 10.1111/j.1467-2494.2005.00279.x. [PubMed] [CrossRef] [Google Scholar]
32. Thomas C.E. The influence of medium components on Cu(2+)-dependent oxidation of low-density lipoproteins and its sensitivity to superoxide dismutase. Biochim. Biophys. Acta. 1992;1128:50–57. doi: 10.1016/0005-2760(92)90256-U. [PubMed] [CrossRef] [Google Scholar]
33. Beretta G., Arlandini E., Artali R., Anton J.M., Maffei Facino R. Acrolein sequestering ability of the endogenous tripeptide glycyl-histidyl-lysine (GHK): Characterization of conjugation products by ESI-MSn and theoretical calculations. J. Pharm. Biomed. Anal. 2008;47:596–602. doi: 10.1016/j.jpba.2008.02.012. [PubMed] [CrossRef] [Google Scholar]
34. Beretta G., Artali R., Regazzoni L., Panigati M., Facino R.M. Glycyl-histidyl-lysine (GHK) is a quencher of alpha,beta-4-hydroxy-trans-2-nonenal: A comparison with carnosine. insights into the mechanism of reaction by electrospray ionization mass spectrometry, 1H NMR, and computational techniques. Chem. Res. Toxicol. 2007;20:1309–1314. doi: 10.1021/tx700185s. [PubMed] [CrossRef] [Google Scholar]
35. Miller D.M., DeSilva D., Pickart L., Aust S.D. Effects of glycyl-histidyl-lysyl chelated Cu(II) on ferritin dependent lipid peroxidation. Adv. Exp. Med. Biol. 1990;264:79–84. [PubMed] [Google Scholar]
36. Boo S., Dagnino L. Integrins as Modulators of Transforming Growth Factor Beta Signaling in Dermal Fibroblasts During Skin Regeneration After Injury. Adv. Wound Care. 2013;2:238–246. doi: 10.1089/wound.2012.0394. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
37. Campbell J.D., McDonough J.E., Zeskind J.E., Hackett T.L., Pechkovsky D.V., Brandsma C.A., Suzuki M., Gosselink J.V., Liu G., Alekseyev Y.O., et al. A gene expression signature of emphysema-related lung destruction and its reversal by the tripeptide GHK. Genome Med. 2012;4:67. doi: 10.1186/gm367. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Meiners S., Eickelberg O. Next-generation personalized drug discovery: The tripeptide GHK hits center stage in chronic obstructive pulmonary disease. Genome Med. 2012;4:70. doi: 10.1186/gm371. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
39. Park J.R., Lee H., Kim S., Yang S.R. The tri-peptide GHK-Cu complex ameliorates lipopolysaccharide-induced acute lung injury in mice. Oncotarget. 2016;7:58405. doi: 10.18632/oncotarget.11168. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Coondoo A., Phiske M., Verma S., Lahiri K. Side-effects of topical steroids: A long overdue revisit. Indian Dermatol. Online J. 2014;5:416–425. doi: 10.4103/2229-5178.142483. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
41. Pickart L. Method of Using Copper(II) Containing Compounds to Accelerate Wound Healing. 5,164,367. U.S. Patent. 1992 Nov 17;
42. Heinrich J., Balleisen L., Schulte H., Assmann G., van de Loo J. Fibrinogen and factor VII in the prediction of coronary risk. Results from the PROCAM study in healthy men. Arterioscler. Thromb. Vasc. Biol. 1994;14:54–59. doi: 10.1161/01.ATV.14.1.54. [PubMed] [CrossRef] [Google Scholar]
43. Lee A.J., Smith W.C.S., Lowe G.D.O., Tunstall-Pedoe H. Plasma fibrinogen and coronary risk factors: The Scottish Heart Health Study. J. Clin. Epidemiol. 1990;43:913–919. doi: 10.1016/0895-4356(90)90075-Z. [PubMed] [CrossRef] [Google Scholar]
44. Pickart L., Vasquez-Soltero J.M., Margolina A. Resetting Skin Genome Back to Health Naturally with GHK. In: Farage M.A., Miller K.W., Maibach H.I., editors. Textbook of Aging Skin. Springer; Berlin, Germany: 2017. [CrossRef] [Google Scholar]
45. Hong Y., Downey T., Eu K., Koh P., Cheah P. A “metastasis-prone” signature for early-stage mismatch-repair proficient sporadic colorectal cancer patients and its implications for possible therapeutics. Clin. Exp. Metastasis. 2010;27:83–90. doi: 10.1007/s10585-010-9305-4. [PubMed] [CrossRef] [Google Scholar]
46. Pickart L., Vasquez-Soltero J.M., Margolina A. GHK Peptide as a Natural Modulator of Multiple Cellular Pathways in Skin Regeneration. BioMed Res. Int. 2015;2015:648108. doi: 10.1155/2015/648108. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Rugină D., Hanganu D., Diaconeasa Z., Tăbăran F., Coman C., Leopold L., Bunea A., Pintea A. Antiproliferative and Apoptotic Potential of Cyanidin-Based Anthocyanins on Melanoma Cells. Int. J. Mol. Sci. 2017;18:949. doi: 10.3390/ijms18050949. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Matalka L.E., Ford A., Unlap M.T. The tripeptide, GHK, induces programmed cell death in SH-SY5Y neuroblastoma cells. J. Biotechnol. Biomater. 2012;2:1–4. doi: 10.4172/2155-952X.1000144. [CrossRef] [Google Scholar]
49. Pickart L., Vasquez-Soltero J.M., Pickart F.D., Majnarich J. GHK, the Human Skin Remodeling Peptide, Induces Anti-Cancer Expression of Numerous Caspase, Growth Regulatory, and DNA Repair Genes. Anal. Oncol. 2014;3:79–89. doi: 10.6000/1927-7229.2014.03.02.2. [CrossRef] [Google Scholar]
50. Imbert I., Gondran C., Oberto G., Cucumel K., Dal Farra C., Domloge N. Maintenance of the ubiquitin proteasome system activity correlates with visible skin benefits. Int. J. Cosmet. Sci. 2010;32:446–457. doi: 10.1111/j.1468-2494.2010.00575.x. [PubMed] [CrossRef] [Google Scholar]
51. Ventafridda V., Fochi C., De Conno D., Sganzerla E. Use of non-steroidal anti-inflammatory drugs in the treatment of pain in cancer. Br. J. Clin. Pharmacol. 1980;10(Suppl. 2):343S–346S. doi: 10.1111/j.1365-2125.1980.tb01820.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
52. Young M.D., Lottes S.R., Webb L.A. An evaluation of cimetidine and ranitidine in the pain relief and acute healing of duodenal ulcer disease. Clin. Ther. 1988;10:543–552. [PubMed] [Google Scholar]
53. Bobyntsev I.I., Chernysheva O.I., Dolgintsev M.E., Smakhtin M.Y., Belykh A.E. Anxiolytic Effects of Gly-His-Lys Peptide and Its Analogs. Bull. Exp. Biol. Med. 2015;156:726–728. doi: 10.1007/s10517-015-2847-3. [PubMed] [CrossRef] [Google Scholar]
54. Chernysheva O.I., Bobyntsev I.I., Dolgintsev M.E. The tripeptide GLY-HIS-LYS influence on behavior of rats in the test “open field” Adv. Mod. Biol. Sci. 2014;12:357–360. [Google Scholar]
55. Sever’yanova L.А., Dolgintsev M.E. Effects of Tripeptide Gly-His-Lys in Pain-Induced Aggressive-Defensive Behavior in Ra. Bull. Exp. Biol. Med. 2017;164:140–143. doi: 10.1007/s10517-017-3943-3. [PubMed] [CrossRef] [Google Scholar]
56. Hostynek J.J., Dreher F., Maibach H.I. Human skin retention and penetration of a copper tripeptide in vitro as function of skin layer towards anti-inflammatory therapy. Inflamm. Res. 2010;59:983–988. doi: 10.1007/s00011-010-0214-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
57. Hall J.M., Cruser D., Podawiltz A., Mummert D.I., Jones H., Mummert M.E. Psychological Stress and the Cutaneous Immune Response: Roles of the HPA Axis and the Sympathetic Nervous System in Atopic Dermatitis and Psoriasis. Dermatol. Res. Pract. 2012;2012:403908. doi: 10.1155/2012/403908. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58. Schwartz J., Evers A.W., Bundy C., Kimball A.B. Getting under the Skin: Report from the International Psoriasis Council Workshop on the Role of Stress in Psoriasis. Front. Psychol. 2016;7:87. doi: 10.3389/fpsyg.2016.00087. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
59. Robinson H., Norton S., Jarrett P., Broadbent E. The effects of psychological interventions on wound healing: A systematic review of randomized trials. Br. J. Health Psychol. 2017;22:805–835. doi: 10.1111/bjhp.12257. [PubMed] [CrossRef] [Google Scholar]
60. Brown J. The impact of stress on acute wound healing. Br. J. Community Nurs. 2016;21(Suppl. 12):S16–S22. doi: 10.12968/bjcn.2016.21.Sup12.S16. [PubMed] [CrossRef] [Google Scholar]
61. Mazurowska L., Mojskin M. Biological activities of selected peptides: Skin penetration ability of copper complexes with peptides. J. Cosmet. Sci. 2008;59:59–69. [PubMed] [Google Scholar]
62. Mazurowska L., Mojski M. ESI-MS study of the mechanism of glycyl-l-histidyl-l-lysine-Cu(II) complex transport through model membrane of stratum corneum. Talanta. 2007;72:650–654. doi: 10.1016/j.talanta.2006.11.034. [PubMed] [CrossRef] [Google Scholar]
63. Swaminathan J., Ehrhardt C. Liposomal delivery of proteins and peptides. Expert Opin. Drug Deliv. 2012;9:1489–1503. doi: 10.1517/17425247.2012.735658. [PubMed] [CrossRef] [Google Scholar]
64. Lalioti V., Muruais G., Tsuchiya Y., Pulido D., Sandoval I.V. Molecular mechanisms of copper homeostasis. Front. Biosci. 2009;14:4878–4903. doi: 10.2741/3575. [PubMed] [CrossRef] [Google Scholar]
65. Szarcvel Szic K., Declerck K., Vidaković M., Vanden B.W. From inflammaging to healthy aging by dietary lifestyle choices: Is epigenetics the key to personalized nutrition? Clin. Epigenet. 2015;7:33. doi: 10.1186/s13148-015-0068-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Kaliman P., Alvarez-López M.J., Cosín-Tomás M., Rosenkranz M.A., Lutz A., Davidson R.J. Rapid changes in histone deaconesses and inflammatory gene expression in expert meditators. Psychoneuroendocrinology. 2014;40:96–107. doi: 10.1016/j.psyneuen.2013.11.004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]