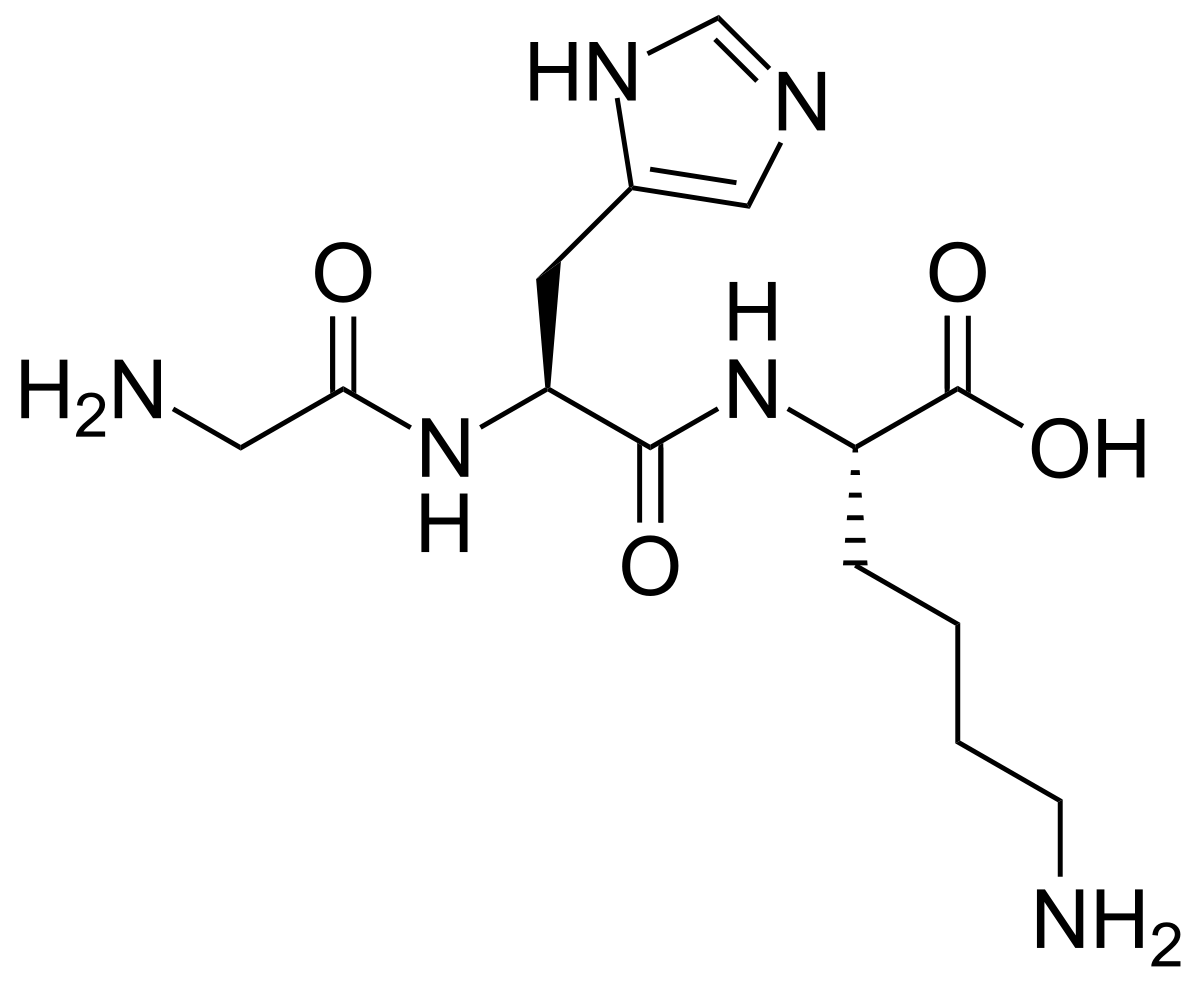
GHK-Cu Tripeptide
Le tripeptide glycy-histidyl-lysine (GHK) est une petite molécule composée de trois chaînes courtes d’acides aminés. On le trouve dans les liquides biologiques sous forme libre ou sous forme d’un complexe qu’il forme avec l’ion Cu2+ (GHK-Cu).
On estime que sa concentration dans le sang est d’environ 200 µg ml−1 entre l’âge de 20 et 25 ans mais elle chuterait à 80 µg ml−1 après l’âge de 60 ans.
Son potentiel thérapeutique est immense : il présente de très nombreuses activités biologiques liées notamment au vieillissement ou aux traitements de la peau. Son mécanisme d’action repose sur la reconfiguration de l’expression normale des gènes, telle qu’on la trouve chez les individus jeunes et en bonne santé.
Quels sont les effets du GHK sur le vieillissement ?
Aujourd’hui, on sait que le vieillissement et les pathologies associées sont le résultat d’une dégradation progressive de la qualité et de l’utilisation du génome (c’est-à-dire l’ensemble de nos gènes). Au fil des années, on constate une diminution de l’activité des gènes chargés de réparer les anomalies et, à l’inverse, une augmentation de l’activité des gènes liés à l’inflammation et à la destruction des tissus (1).
Pendant longtemps, la recherche s’est mis en tête de découvrir le mécanisme très précis qui intervient dans ce phénomène, alors qu’en réalité, l’ensemble des données nous montre que de très nombreux mécanismes sont impliqués et que des milliers de gènes sont en jeu.
Le GHK répond parfaitement à cette problématique puisqu’il semble capable de reconfigurer l’activité d’un nombre incalculable de gènes. Mieux, il rectifie cette activité pour qu’elle se rapproche de celle des personnes jeunes.
Il peut donc constituer une avancée potentielle pour prévenir et traiter les conditions typiquement associées au vieillissement tels que le cancer, la maladie d’Alzheimer, les rétinopathies, l’athérosclérose, etc.
D’où vient le GHK-Cu ?
Le GHK a été découvert par des chercheurs qui souhaitaient comparer le sang de personnes jeunes avec celui de personnes âgées de plus de 50 ans. Ils se sont aperçus que le sang des plus jeunes avait tendance à inhiber la synthèse de fibrinogène, une protéine qui intervient dans de nombreux processus pathologiques. En creusant, ils ont réussi à identifier le facteur actif qui n’est autre que le GHK.
Depuis cette découverte, des dizaines d’études ont démontré que cette simple molécule pouvait améliorer la cicatrisation des blessures, favoriser la régénération des tissus (en particulier ceux de la peau, du cuir chevelu, des os et du foie), augmenter la synthèse de collagène, de décorine et des glycosaminoglycanes, améliorer l’angiogenèse et la neurogénèse, présenter des effets antioxydants et anti-inflammatoires (2-4) …
Quels sont les bienfaits du GHK ?
Comment une molécule si simple peut accomplir autant de choses ? En modifiant l’expression de 32 % des gènes humains, ce qui est considérable (5). Au cours d’une étude récente, l’analyse informatique a sélectionné le GHK parmi 1309 molécules bioactives comme étant le meilleur choix pour réinitialiser l’activité de gènes « malades ». Cette capacité de régulation lui permet d’agir sur six domaines principaux :
1) La suppression de la fibrinogène
La fibrinogène est une protéine qui se transforme en fibrine dans le plasma sanguin et qui favorise l’inflammation. Sa concentration dans le sang est un excellent prédicateur de mortalité, surtout chez les personnes qui présentent des complications cardiovasculaires (6-7). Elle affecte la rigidité des vaisseaux et la viscosité du sang, ralentissant la circulation sanguine.
Le GHK freine l’expression des gènes liés à la synthèse de fibrinogène, diminuant par effet domino la production de cytokines pro-inflammatoires comme l’IL-6, lui-même un régulateur de la synthèse de fibrinogène (8).
Pathologies potentiellement impliquées : troubles cardiovasculaires, AVC, infarctus du myocarde.
2) L’activation du protéasome
Le protéasome est une structure cellulaire géante chargée de détruire les protéines endommagées dans les cellules. Cela permet d’éviter qu’elles s’accumulent dans les cellules et provoquent un chaos susceptible de nuire au fonctionnement général de l’organisme. L’accumulation de protéines malformées est caractéristique du vieillissement et de certaines pathologies neurodégénératives comme le maladie d’Alzheimer. En réactivant l’expression de 41 gènes liés au fonctionnement du protéasome (9-10), le GHK retarderait les effets du vieillissement (11).
Pathologies potentiellement impliquées : maladies neurodégénératives.
3) L’activation des gènes spécialisés dans la réparation de l’ADN
Chaque jour, on estime que les dégâts infligés à l’ADN sont de 1000 à 1 million par cellule. Ces dégâts sont majoritairement dus à des facteurs environnementaux comme le rayonnement UV, la pollution, le stress, etc. Fort heureusement, il existe des systèmes de réparation complexes qui corrigent la quasi-totalité des anomalies apparues.
Avec le temps, cependant, les erreurs qui ont échappé à la réparation s’accumulent et finissent par perturber l’activité des gènes correcteurs. Un système de réparation défaillant est clairement associé à la sénescence et constitue une porte ouverte à un nombre d’anomalies croissant et à la formation d’un cancer (12-13). Le GHK réinitialise et amplifie l’activité de 47 gènes associés aux systèmes de réparation, suggérant une meilleure efficacité correctrice.
Pathologies potentiellement impliquées : cancers.
4) L’activation des gènes impliqués dans l’antioxydation
Les radicaux libres, issus du fonctionnement normal de l’organisme ou de facteurs environnementaux comme la pollution ou l’alcool, sont susceptibles de causer des dommages à l’ADN, aux membranes des cellules ou aux protéines de l’organisme. Un système antioxydant est donc nécessaire pour s’opposer à ces derniers et s’assurer que les dommages seront réduits au maximum.
Au cours du vieillissement, cependant, et dans de nombreux processus pathologiques, la balance entre les agents oxydants et les antioxydants est déséquilibrée. Le surnombre des agents oxydants provoque un stress oxydatif (14) associé à l’athérosclérose, au cancer, à la cataracte, au diabète, aux néphropathies, à la maladie d’Alzheimer et à d’autres conditions pathologiques liés au vieillissement.
Le GHK stimulerait 14 gènes associés aux systèmes antioxydants tandis qu’il freinerait l’expression de 2 gènes liés à l’oxydation.
Pathologies potentiellement impliquées : la plupart des maladies liées au vieillissement.
5) Le contrôle des gènes impliqués dans le cancer
En 2010, une équipe de chercheur a mis en évidence 54 gènes associés au cancer du côlon le plus agressif (15). Ils ont identifié le GHK et la sécurinine comme étant les composés les plus susceptibles d’intervenir sur l’expression différentielle de ces gènes.
Le GHK permettrait notamment de réactiver les systèmes de contrôle qui déclenchent le suicide des cellules cancéreuses, en augmentant l’activité de 6 des 12 gènes impliqués dans ce phénomène qu’on appelle l’apoptose.
Pathologies potentiellement impliquées : cancers.
6) La réparation des tissus
Le GHK semble également agir sur la régénération par le biais de son influence sur les facteurs de croissance de la superfamille TGF-β. Son action semble notamment importante lors de la dernière étape de la cicatrisation, le remodelage.
Le traitement de différents animaux avec le GHK a montré une activation efficace du système de cicatrisation (16-19).
Pathologies potentiellement impliquées : troubles liés à la peau, au cuir chevelu, au foie, à l’estomac, etc.
Qu’est-ce que l’expression des gènes ?
Une cellule vivante s’apparente un peu à un orchestre. Lorsque le chef d’orchestre lève sa baguette et qu’il amorce une série de mouvements complexes, certains musiciens attaquent la partition tandis que d’autres n’interviennent qu’à des moments précis, augmentant ou diminuant la puissance des sons qu’ils tirent de leur instrument. L’ensemble est parfaitement coordonné de manière à produire une magnifique symphonie qui ravit l’auditoire.
De la même manière, la cellule ne fait pas appel à tous ses gènes en même temps et avec la même intensité. Grâce à des mécanismes précis et complexes, elle fait s’exprimer les gènes qui sont les plus à même de répondre à la situation à laquelle elle est confrontée à un instant t. L’expression des gènes sera donc très différente si l’individu est en train de se nourrir, s’apprête à dormir, tombe malade ou s’il est soumis à un stress intense.
Malheureusement, l’harmonie et la coordination qui régissent l’expression adéquate des gènes ne sont pas toujours optimales, notamment au cours du vieillissement. Lorsque l’expression des gènes se déroule anormalement, des déséquilibres sérieux et des maladies peuvent apparaître, comme le cancer. Certains gènes, qui pourraient s’avérer fortement utiles, ne sont plus exprimés, tandis que d’autres, néfastes, le sont abondamment.
Comment une substance peut-elle influer sur l’expression des gènes ?
Une cellule humaine quelconque n’exprime probablement qu’environ 20 % de ses gènes à la fois, et cette proportion est encore plus faible dans les cellules hautement spécialisées comme les cellules musculaires ou les cellules nerveuses. Pourtant, toutes les cellules contiennent exactement les mêmes gènes. Les différences entre les types de cellules ne sont donc pas attribuables à la présence des gènes, mais plutôt à l’expression différentielle de ces gènes, qui permet à des cellules dont le génome est identique d’exprimer des gènes différents.
Cette expression est assurée par des molécules qui « indiquent » à la cellule quels gènes elle doit exprimer à un moment donné. Le GHK fait partie de ce groupe de molécules. Comment s’y prennent-elles ? La plupart d’entre elles, comme le GHK, se lient à des récepteurs situés à la surface de la cellule. Elles ne pénètrent jamais dans celles-ci mais elles peuvent assurer la régulation génique indirectement en mettant en marche des voies de transduction menant à l’activation, à la répression ou à l’amplification de l’expression des gènes.
En fait, elles « obligent » une cellule à exprimer certains gènes, ce qui se traduit par des modifications cellulaires et même physiologiques observables.
Les formes du GHK-Cu
Le GHK-Cu a une durée de vie assez faible dans l’organisme, environ 1 heure. Cet intervalle de temps est néanmoins suffisant pour agir, la petite taille du GHK lui permettant de circuler rapidement dans l’espace extra-cellulaire et d’accéder facilement aux récepteurs cellulaires.
En revanche, l’administration classique sous forme de gélules n’aurait que peu d’effets sur l’organisme en raison de la sensibilité extrême du GHK à l’action de la carboxypeptidase (20), une enzyme qu’on trouve au niveau de l’intestin. On pense en effet que la plupart des molécules de GHK-Cu ne franchiraient pas intactes la barrière intestinale (21-22). C’est la raison pour laquelle les chercheurs travaillent essentiellement au moyen d’injections, de comprimés liposomaux ou sublinguaux.
En tant qu’agent thérapeutique potentiel, le GHK présente un avantage incomparable par rapport à ses autres prétendants : ses effets sur la modulation des gènes correspondent à des découvertes effectuées dans des expériences in vivo, c’est-à-dire en situation réelle.
Références
- C. Franceschi and J. Campisi, “Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases,” The Journals of Gerontology, vol. 69, supplement 1, pp. s4–s9, 2014
- L. Pickart, “The human tri-peptide GHK and tissue remodeling,” Journal of Biomaterials Science, Polymer Edition, vol. 19, no. 8, pp. 969–988, 2008
- H. R. Choi, Y. A. Kang, S. J. Ryoo et al., “Stem cell recovering effect of copper-free GHK in skin,” Journal of Peptide Science, vol. 18, Article ID 685G690, pp. 685–690, 2012.
- S. Jose, M. L. Hughbanks, B. Y. Binder, G. C. Ingavle, and J. K. Leach, “Enhanced trophic factor secretion by mesenchymal stem/stromal cells with Glycine-Histidine-Lysine (GHK)- modified alginate hydrogels,” Acta Biomaterialia, vol. 10, pp. 1955–1964, 2014
- L. Pickart, J. M. Vasquez-Soltero, F. D. Pickart, and J. Majnarich, “GHK, the human skin remodeling peptide, induces anti-cancer expression of numerous caspase, growth regulatory, and DNA repair genes,” Journal of Analytical Oncology, vol. 3, no. 2, pp. 79–87, 2014.
- K. Yano, J. S. Grove, R. Chen, B. L. Rodriguez, J. D. Curb, and R. P. Tracy, “Plasma fibrinogen as a predictor of total and cause-specific mortality in elderly Japanese-American men,” Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 21, no. 6, pp. 1065–1070, 2001.
- M. Benderly, E. Graff, H. Reicher-Reiss, S. Behar, D. Brunner, and U. Goldbourt, “Fibrinogen is a predictor of mortality in coronary heart disease patients,” Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 16, no. 3, pp. 351–356, 1996.
- C. L. Carty, P. Heagerty, S. R. Heckbert et al., “Interaction between fibrinogen and IL-6 genetic variants and associations with cardiovascular disease risk in the cardiovascular health study,” Annals of Human Genetics, vol. 74, no. 1, pp. 1–10, 2010.
- N. R. Jana, “Protein homeostasis and aging: role of ubiquitin protein ligases,” Neurochemistry International, vol. 60, no. 5, pp. 443–447, 2012.
- N. Chondrogianni, M. Sakellari, M. Lefaki, N. Papaevgeniou, and E. S. Gonos, “Proteasome activation delays aging in vitro and in vivo,” Free Radical Biology & Medicine C, vol. 71, pp. 303– 320, 2014.
- N. Chondrogianni, M. Sakellari, M. Lefaki, N. Papaevgeniou, and E. S. Gonos, “Proteasome activation delays aging in vitro and in vivo,” Free Radical Biology & Medicine C, vol. 71, pp. 303– 320, 2014.
- P. J. Hohensinner, J. J. Goronzy, and C. M. Weyand, “Targets of immune regeneration in rheumatoid arthritis,” Mayo Clinic Proceedings, vol. 89, no. 4, pp. 563–575, 2014.
- B. Debrabant, M. Soerensen, F. Flachsbart et al., “Human longevity and variation in DNA damage response and repair: study of the contribution of sub-processes using competitive gene-set analysis,” European Journal of Human Genetics, vol. 22, no. 9, pp. 1131–1136, 2014.
- I. S. Young and J. V. Woodside, “Antioxidants in health and disease,” Journal of Clinical Pathology, vol. 54, no. 3, pp. 176–186, 2001.
- Y. Hong, T. Downey, K. W. Eu, P. K. Koh, and P. Y. Cheah, “A ‘metastasis-prone’ signature for early-stage mismatch-repair proficient sporadic colorectal cancer patients and its implications for possible therapeutics,” Clinical and Experimental Metastasis, vol. 27, no. 2, pp. 83–90, 2010
- P. V. Peplow and G. D. Baxter, “Gene expression and release of growth factors during delayed wound healing: A review of studies in diabetic animals and possible combined laser phototherapy and growth factor treatment to enhance healing,” Photomedicine and Laser Surgery, vol. 30, no. 11, pp. 617–636, 2012.
- K. Deonarine, M. C. Panelli, M. E. Stashower et al., “Gene expression profiling of cutaneous wound healing,” Journal of Translational Medicine, vol. 5, article 11, 2007.
- P. J. Murray and S. T. Smale, “Restraint of inflammatory signaling by interdependent strata of negative regulatory pathways,” Nature Immunology, vol. 13, no. 10, pp. 916–924, 2012.
- T. Arodz, D. Bonchev, and R. F. Diegelmann, “A network approach to wound healing,” Advances in Wound Care, vol. 2, no. 9, pp. 499–509, 2013.
- Schlesinger D.H., Pickart L., Thaler M.M. Growth-modulating serum tripeptide is glycyl-histidyl-lysine. Experientia. 1977;33:324–325. doi: 10.1007/BF02002806
- P. Li, H. M. Nielsen, and A. Mullertz, “Oral delivery of peptides ¨ and proteins using lipid-based drug delivery systems,” Expert Opinion on Drug Delivery, vol. 9, no. 10, pp. 1289–1304, 2012.
- J. Swaminathan and C. Ehrhardt, “Liposomal delivery of proteins and peptides,” Expert Opinion on Drug Delivery, vol. 9, no. 12, pp. 1489–1503, 2012